جدول اوربیتال
این جدول پیکر بندی همه اوربیتالها رابرای توابع موج هیدروژن گونه تا اوربیتال 7s نشان میدهد و در نتیجه پیکربندیهای الکترونی ساده را برای همه عناصر در جدول تناوبی تا رادیوم پوشش میدهد.
انرژی اوربیتال
در اتمی با یک الکترون منفرد (اتمهای هیدروژن گونه)، انرژی هر اوربیتال (و به تبع آن، انرژی هر الکترون در اوربیتال) منحصرا توسطتعیین میشود.اوربیتال
کمترین میزان انرژی ممکن را در اتم دارد. هر یک از مقادیرمتوالی بالاتر
سطح انرژی بالاتری دارند، اما اختلاف انرژیها با افزایش
کاهش مییابد. برای
بزرگ، سطح انرژی به حدی زیاد است که الکترونها به آسانی میتواند از اتم فرار کنند.
در اتمهای با الکترونها ی بیشتر، انرژی الکترون نه تنها از خواص ذاتی اوربیتال آن است، بلکه به بر هم کنش با الکترونهای دیگرنیز بستگی دارد. این بر هم کنشها به جزئیات توزیع احتمال مکانی آن الکترون بستگی دارد، و بنابراین سطح انرژی اوربیتالها نه تنها بهبستگی دارد، بلکه به
نیز وابستهاست. مقادیر بالاتر از
مقادیر بالاتری از انرژی همراه خواهند شد؛ به عنوان مثال، حالت p2 انرژی بیشتری از حالت s2 دارد. وقتی که
= 2 است انرژی اوربیتال به قدری افزایش مییابد که انرژی اوربیتال، به انرژی بالاتر ازانرژی اوربیتال s لایه بالاتر میرسد(رانده میشود)؛ هنگامی که
= 3 است انرژی به سطح انرژی دو مرحله بالاتر رانده شدهاست.
ترتیب انرژی 24 زیر لایه اول جدول زیر داده شدهاست. هر خانه نشان دهنده یک زیر لایهاست که با n ومربوطه مشخص میشود.عدد داخل هر خانه نشان دهنده رتبه انرژی آن زیر لایه نسبت به سایر زیر لایهها است.
1 1 2 2 3 3 4 5 7 4 6 8 10 13 5 9 11 14 17 21 6 12 15 18 22 26 7 16 19 23 27 31 8 20 24 28 32 36
توجه :خانههای خالی زیر لایههایی را که موجود نیستند نشان میدهند، در حالی که خانههایی که اعدادشان ایتالیک نوشته شدهاند زیر لایههایی هستند که میتوانند وجود داشته باشند اما در هیچ یک از عناصر شناخته شده فعلی قادر به نگه داشتن الکترونها نیستند.
دوست عزیز، به سایت علمی نخبگان جوان خوش آمدید
مشاهده این پیام به این معنی است که شما در سایت عضو نیستید، لطفا در صورت تمایل جهت عضویت در سایت علمی نخبگان جوان اینجا کلیک کنید.
توجه داشته باشید، در صورتی که عضو سایت نباشید نمی توانید از تمامی امکانات و خدمات سایت استفاده کنید.






.gif)













































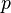
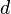
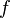


 پاسخ با نقل قول
پاسخ با نقل قول


علاقه مندی ها (Bookmarks)