گوگرد
گوگرد ( Sulfur ) :
نمايي از عنص گوگرد
سولفور ( گوگرد ) در سنگهای آسمانی ، آتشفشانها ، چشمه های آب داغ و به عنوان گالن یا سرب معمولی ، ژیپس ، نمک های اپسون و باریت یافت شود . برای کارهای بازرگانی از پشته های نمکی سواحل خمیجی در آمریکا بدست می آید . ماه های مشتری رنگ های خود را به دلیل رنگ های متنوع گوگرد دار می باشند . رنگ های تیره در اطراف ماه شاید نشانه تجمع گوگرد باشد .
این عنصر در شهابسنگها پیدا می شود . دانشمندان اولین با سولفور را در دهانه آتشفشانها پیدار کردند. گوگرد در مجاورت دهانه آتشفشانهای فعال تولید می شود. این عنصر به طور گسترده ای در طبیعت در سنگهای پیریت آهن دار، گالن، اسفالریت، سینابر، استیبنیت، ژیپس، نمکهای دی سولفات منیزیوم، سلستین و باریت یافت می شود.
گوگرد از چاههای عمیق و گنبدهای نمکی به دست می آید . در اثر فرایند گرم شدن آب در اعماق گوگرد ذوب شده به سطح زمین می اید. گوگرد در گازهای طبیعی و نفت خام نیز وجود دارد.
سولفور به رنگهای زرد کمرنگ، بی رنگ است جامدی شکننده می باشد که در آب نامحلول است اما در دی سولفید کربن حل می شود. به هر سه حالت جامد و مایع و گاز یافت می شود. این عنصر دارای خصوصیات غیر عادی نوری و الکتریکی است.
سولفور با خلوص بالا به صورت بی شکل با خنک کردن سریع بلورهای آن تولید می شود. مطالعات اشعه ایکس در مورد این عنصر نشان می دهد که دارای ساختار مارپیچی و 8 اتم در هر مارپیچ می باشد. در طرح اشعه ایکس نرمال گوگرد بلوری به صورت حلقه ای به نظر می رسد و شامل 8 اتم گوگرد است که به یکدیگر متصل شده اند.
عنصر گوگرد دارای 11 ایزوتوپ است. 4 تا از این ایزوتوپها به صورت رادیواکتیو نیستند.
ترکیبات آلی گوگرد شامل سولفور کلسیم و سولفات آمونیوم و دی سولفید کربن و دی اکسید گوگرد و سولفید هیدروژن که ترکیبات مهمی هستند.
گوگرد یکی از اجزا سازنده باروت سیاه می باشد و برای حرارت دادن لاستیک طبیعی و قارچ کشها کاربرد دارد. این عنصر همچنین برای ساخت کودهای شیمیایی فسفاته نیز به کار می رود. این عنصر در مقدار زیاد می تواند تولید اسیدسولفوریک کند که در ساخت مواد شیمایی مهم کاربرد اساسی دارد. همچنین برای ساخت کاغذهای سولفیده ، ضد عفونی کردن مواد و رنگبری و خشک کردن میوه کاربرد دارد. این عنصر نارسانای خوبی است و نقش مهمی در حیات دارد.
در موقع کار با ترکیبات سولفور و سولفور در آزمایشگاه باید دقت لازم را به عمل آورد. سولفید هیدروژن رقیق می تواند متابولیزه شود اما موقع کار با غلیظ آن باید دقت کرد تا به دستگاه تنفسی آسیب نرسد. این ترکیب حس بویایی را بی حس می کند و به آن آسیب می رساند. اکسید گوگرد ترکیب خطرناکی است که باعث آلودگی هوا می شود.
ساختار بلوري عنصر گوگرد
اثرات گوگرد بر سلامتي انسان
معمولاً گوگرد در طبيعت به صورت سلفيد ديده ميشود. طي برخي از فرآيندها پيوندهاي مختلفي از گوگرد تشکيل و وارد محيط زيست ميشود و به جانوران و انسان آسيب ميرساند. پيوندهاي گوگردي طي واکنشهاي متنوعي شکل ميگيرند. شکل گيري اين پيوندها زماني اتفاق مي افتد که در محيط به غير از مواد طبيعي، مواد مصنوعي هم وجود داشته باشد. اين ترکيبات طرفدار چنداني ندارند زيرا داراي بوي زننده اي هستند و اغلب سمهاي قوي تشکيل ميدهند.
مواد گوگردي اثرات زير را بر سلامت انسان ميگذارند:
تاثير برسيستم عصبي و تغيير رفتار
ايجاد مشکلاتي در گردش خون
مشکلات قلبي
تاثير برچشمها و بينايي
مشکلات توليد مثلي
ناهنجاري در معده و روده
ايجاد مشکلات در کبد و کليه ها
تاثير بر ميزان شنوايي فرد
ايجاد مشکل در سيستم متابوليسم هورموني
تاثير بر پوست
خفگي و انسداد ريه ها
اثرات گوگرد بر محيط زيست
گوگرد به اشکال مختلف در طبيعت وجود دارد. اگر مقدار گوگرد در هواي تنفسي (به صورت فاز گازي) از حد معمول خود بيشتر باشد، باعث تحريک چشها و گلو در جانوران ميشود. گوگرد در صنعت کاربرد زيادي دارد و به طور گسترده در هوا منتشر ميشود. احتمال تخريب پيوندهاي گوگردي کم است.
اثرات تخريبي گوگرد بر جانوران اکثراً به صورت آسيبهاي ذهني است. زيرا گوگرد کارآيي هيپوتالاموس را پايين مي آورد و بر سيستم عصبي اثر ميکند.
تستهاي آزمايشگاهي که بر جانوران انجام شده نشان ميدهد که گوگرد بر رگهاي مغز، قلب و کليه ها اثر ميگذارد. اين تستهاي آزمايشگاهيي نشان ميدهد که اشکال خاصي از گوگرد سبب بروز آسيبهايي برجنين شده ومشکلات مادرزادي به همراه دارد. همچنين در دوران شيردهي، مادران مقداري گوگرد را همراه شير خود به بدن نوزاد منتقل ميکنند.
در نهايت، گوگرد باعث صدمه زدن به سيستم آنزيم جانوران ميشود.
عنصر گوگرد در طبيعت
خواص فیزیکی و شیمیایی عنصر گوگرد :
عدد اتمی: 16
جرم اتمی: 32.066
نقطه ذوب : C°113
نقطه جوش: C°445
شعاع اتمی: Å 1.09
ظرفیت: 2,4,6
رنگ: زرد
حالت استاندارد: جامد
نام گروه: 6
انرژی یونیزاسیون: Kj/mol 999.3
شکل الکترونی: [Ne]3s23p4
شعاع یونی : Å 0.37
الکترونگاتیوی: 2.5
حالت اکسیداسیون: ±2,4,6
دانسیته: 2.07
گرمای فروپاشی: Kj/mol 1.117
گرمای تبخیر : Kj/mol 9.82
مقاومت الکتریکی : Ohm m 2×10-5
گرمای ویژه: J/g Ko 0. 71
دوره تناوبی:3
شماره سطح انرژی : 3
اولین انرژی : 2
دومین انرژی : 8
سومین انرژی : 6
ایزوتوپ :
ایزوتوپ نیمه عمر
S-32 پایدار
S-33 پایدار
S-34 پایدار
S-35 87.2 روز
S-36 پایدار
اشکال دیگر :
دی اکسید سولفور SO2 و مونوکسید گوگرد SO3
هیدرید سولفور H2S
دی کلرید سولفور SCl2و دی کلرید دی سولفور S2Cl2
موارد استفاده : کبریت سازی ، پودر تفنگ ، پزشکی ، لاستیک سازی و باتری سازی
منابع : گوگرد ، کانی پریت و گاز طبیعی
دوست عزیز، به سایت علمی نخبگان جوان خوش آمدید
مشاهده این پیام به این معنی است که شما در سایت عضو نیستید، لطفا در صورت تمایل جهت عضویت در سایت علمی نخبگان جوان اینجا کلیک کنید.
توجه داشته باشید، در صورتی که عضو سایت نباشید نمی توانید از تمامی امکانات و خدمات سایت استفاده کنید.






 پاسخ با نقل قول
پاسخ با نقل قول























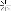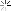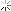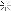


علاقه مندی ها (Bookmarks)