انرژی آزاد هلمولتز تابعی ترمودینامیکی است که توانایی سیستم برای انجام کار را در شرایط همدما نشان میدهد.
تعریف
که در آن:
- U انرژی درونی سیستم،
- T دمای سیستم در مقیاس کلوین و
- S انتروپی سیستم است.
دوست عزیز، به سایت علمی نخبگان جوان خوش آمدید
مشاهده این پیام به این معنی است که شما در سایت عضو نیستید، لطفا در صورت تمایل جهت عضویت در سایت علمی نخبگان جوان اینجا کلیک کنید.
توجه داشته باشید، در صورتی که عضو سایت نباشید نمی توانید از تمامی امکانات و خدمات سایت استفاده کنید.




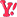


 پاسخ با نقل قول
پاسخ با نقل قول که در آن
که در آن  تغییرات انرژی درونی
تغییرات انرژی درونی  تغییرات گرما
تغییرات گرما  تغییرات کار
تغییرات کار
 که در آن α ضریب انبساط حرارتی خطی،
که در آن α ضریب انبساط حرارتی خطی،  طول اولیه،
طول اولیه، 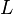 طول ثانویه و
طول ثانویه و 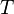 دما است.
دما است.
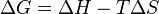 که در آن
که در آن



علاقه مندی ها (Bookmarks)