دیستروفی ماهیچه ای دوشن به اختصار DMD ، شایعترین و شدیدترین نوع از بیماریهای دیستروفی ماهیچهای از گونه (وابسته به X) و ژنتیکی است.
نام بیماری دیستروفی ماهیچهای دوشن برگرفته از نام یک پزشک مختصص مغز و اعصاب فرانسوی به نام " گیوم بنیامین اماند دوشن "است که اولین بار در سال 1861 شرح بیماری دوشن را در مجلات پزشکی آن زمان منتشر کرد.
از عوارض اصلی این بیماری تحلیل و نابودی ماهیچههای ارادی (که در کنترل بدن نقش حیاتی دارند) است که در مواقع شدید نهایتاً منجر به عدم توانایی در راه رفتن ،۹۶% معلولیت، مشکلات تنفسی و مرگ می شود.
عامل بیماری
بیماری دیستروفی ماهیچهای دوشن در اثر نقص در کرموزوم ایکس و فقدان پروتئین دیستروفین ایجاد میشود. ژن مسئول ساخت این پروتئین (DMD) است و بر روی کرموزوم ایکس ( 21xp ) قرار دارد. پروتئین دیستروفین اطراف سلولهای ماهیچهای برای محافظت ساختمان عضله ساخته میشوند و مانع از خروج عناصر داخل سلول عضلانی به فضای خارج از سلول میشود.بدون دیستروفین سلول عضلانی قابل نفوذ خواهد بود و مواد بافت خارج سلولی وارد سلول عضله شده و باعث تخریب و مرگ عضله خواهد شد و در نهایت بافت چربی جای عضله را میگیرد. علت عدم تولید پروتئین دیستروفین در ژن دی ام دی هنوز به طور قطع مشخص نیست ولی این عدم تولید ناشی از مسدود شدن مجاری تولید پروتئین دیسترفین میباشد. پروتئین دیستروفین در بدن افراد طبیعی کمتر از 002/0 میلی گرم از کل پروتئین بافت عضلانی است.
نشانه ها و عوارض
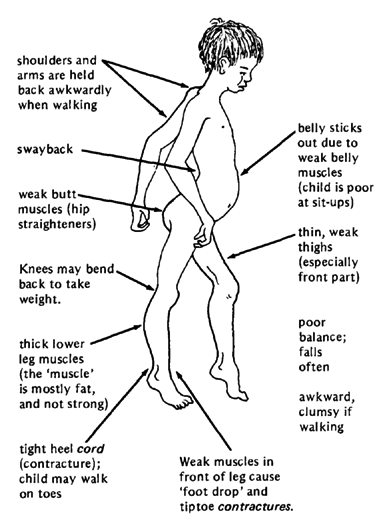
به طور کلی علایم بیماری در ۶ سالگی ظاهر میشود گرچه در دوران نوزادی هم نمایان است. نوزاد در موقع تولد کاملاً سالم به نظر میرسد، ولی هنگامی که شروع به حرکت میکند، حتی زمانی که با چهار دست و پا و یا سینه خیز مینماید حرکت او کندتر از همسالان خود است و زود به زود خسته میشود. هنگامی که به راه میافتد ضعف ماهیچه ای به تدریج واضح تر میشود. معمولاً والدین نسبت به نحوه راه رفتن غیر طبیعی یا اشکال در برخاستن فرزندشان از روی زمین، راحت زمین خوردن، اشکال در بالا رفتن از پلهها و عدم توانایی دویدن یا انجام حرکات ورزشی در مقایسه با همسالانشان نگران میشوند. بزرگ شدن غیر طبیعی ماهیچههای ساق پا و ضعف خفیف تا متوسط ماهیچههای ابتدای اندام تحتانی، به صورت راه رفتن اردک وار و عدم توانایی در برخاستن راحت از روی زمین تظاهر میکنند. این کودکان به طور مشخص برای برخاستن از حالت نشسته از پاها و بدنشان کمک میگیرند که به نشانه گاور معروف است. تحلیل ماهیچه ای به صورتی است که در ۸ سالگی کاملاً ضعف ماهیچهها بارز میشود. این تحلیل ماهیچهای ابتدا از پاها و لگن شروع، باعث کاهش حجم و نابودی ماهیچههای این ناحیه میشود و نهایتاً دستها، بازوها و شانه را نیز در بر میگیرد که موجب افتادگی شانه میشود. در ۱۰ سالگی بیمار توانایی راه رفتن را از دست میدهد و به ویلچر نیاز پیدا میکند. از آنجایی که دو سوم از وزن بدن از ماهیچهها تشکیل شده است، با نابودی ماهیچهها وزن بدن به شدت کاهش می یابد و به یک سوم از کل آن می رسد. در بیشتر مواقع پیشرفت بیماری ادامه مییابد و به علت رشد غیر طبیعی استخوانهای ستون فقرات، ستون فقرات به صورت حرف S انحنا پیدا میکند و قفسه سینه اندکی تغییر شکل می دهد که سبب جمع شدگی بدن می شود. پیشرفت بیماری در مواقع شدید نهایتاً با مشکلات تنفسی و مرگ همراه خواهد بود، طول عمر متوسط برای بیماران معمولاً بین ۲۰ تا ۳۰ سال است.نشانههای نهفته و موجود در خون
بالا بودن میزان آنزیم ماهیچهای کراتین کیناز «Creatine kinase (CPK-MM)» در خون
تست ژنتیک نقض در کرموزوم ایکس را افشا می کند
الکترومیوگرافی از بافت عضلانی نشان می دهد که تحلیل عضلات ناشی از با نفوذ شدن بافت عضلانی در اثر نقص در تولید پروتئین دیستروفین است نه در اثر اعصاب.
نمونه برداری از بافت عضله فقدان پروتئین دیستروفین را تایید می کند. آزمایش پیش از تولد
اگر یکی یا هردو والدین حامل بیماری خاصی باشد، مبتلا شدن فرزند به دنیا نیامده آنها به آن بیماری ریسک است. آزمایش پیش از تولد برای پیدا کردن جنین مبتلا به دوشن در دوران بارداری انجام میشود، این آزمایشها تنها برای برخی از اختلالات عصبی و ماهیچه ای کاربرد دارد. انواع آزمایشهای پیش از تولد می تواند بعد از حدود ۱۱ هفته پس از بارداری به اجرا دربیاید. نمونه برداری از برآمدگی مویی پرده بیرونی جنین (CVS) در هفته ۱۱ تا ۱۴ بارداری انجام و تست پرده آمنیون مایع بعد از هفته ۱۵ بارداری انجام میشود، در حالی که نمونه خون جنین می تواند حدوداً در هفته ۱۸ بارداری صورت گیرد. زنان و یا زوجها باید دقت نظر داشته باشند که...پس از انجام آزمایش در مورد آن با مشاور ژنتیک به بحث بنشیند. در صورتی که آزمایش پیش از تولد ابتلا جنین به بیماری دوشن را مشخص کند دستور سقط جنین صادر میشود تا از تولد نوزاد بیمار جلوگیری شود.
افسردگی بیماران
از آنجا که بیماری دوشن یک بیماری بسیار حاد است و در مدت کوتاهی زندگی بیماران و خانوادههای آنان را دگرگون میکند، عمدتاً مبتلایان به این بیماری را در کودکان، نوجوانان و جوانان تشکیل می دهند، به علت عدم پذیرش معلولیت از سوی مبتلایان و به خصوص در جامعه ما که برای بیماران هیچ گونه تمهیدات، مناسب سازی و برنامه ای انجام نشده و عدم فرهنگ سازی که مردم با ترحم به بیماران نگاه می کنند.، موارد زیادی از افسردگی میان جوانان مبتلا به این بیماری وجود دارد. همچنین دیستروفی ماهیچه ای دوشن به دلیل نوع پیشرونده بودن بیماری، نهایتاً منجر به معلولیت شخص میشود، این موضوع می تواند عوارض روحی و روانی را در مبتلایان و خانوادههای آنها را به دنبال داشته باشد . به دلیل این مسأله حتی چند مورد خودکشی مادران بیماران گزارش شده است.
درمان
تاکنون هیچ درمانی برای دیستروفی ماهیچه ای دوشن یافت نشده است اگرچه اخیراً تحقیقات نشان می دهد به وسیله سلولهای بنیادی می توان بافت ماهیچههای سالم را جایگزین بافت ماهیچه ای آسیب دیده کرد. تنها با فزیوتراپی و کاردرمانی می توان از انحراف ستون فقرات و قفسه سینه که موجب جمع شدگی بدن میشود جلوگیری کرد
سلولهای بنیادی
محققان " بیمارستان اطفال پیتسبورگ " دسته منحصر به فردی از سلولهای بنیادی بزرگسال را شناسایی کردهاند که میتواند بیماریهایی نظیر حمله قلبی و دیستروفی ماهیچه ای دوشن را درمان کند. دانشمندان سلولهای بنیادی "میوآندوتلیال" myoendothelial را جداسازی و مشخص کردند، این سلولها با استفاده از فناوریهای جداسازی سلول به راحتی جدا میشوند، به سرعت تکثیر مییابند و میتوانند در محیط آزمایشگاه به سلولهای ماهیچه ای، استخوان و غضروف تمایز پیدا کنند. کشف این دسته سلولهای بنیادی در یک منبع انسانی موفقیت بزرگی به شمار میرود، زیرا به کاربرد بالینی این درمان بسیار نزدیکتر می شود. به گفته دانشمندان، پیوند هزار سلول میوآندوتلیال به ماهیچه آسیب دیده موشهایی که دچار نقص ایمنی بودند بطور متوسط ۸۹ لیف عضلانی تولید کرد.
منبع
دوست عزیز، به سایت علمی نخبگان جوان خوش آمدید
مشاهده این پیام به این معنی است که شما در سایت عضو نیستید، لطفا در صورت تمایل جهت عضویت در سایت علمی نخبگان جوان اینجا کلیک کنید.
توجه داشته باشید، در صورتی که عضو سایت نباشید نمی توانید از تمامی امکانات و خدمات سایت استفاده کنید.



.gif)
 پاسخ با نقل قول
پاسخ با نقل قول


علاقه مندی ها (Bookmarks)