هنگام ایجاد یک پیوند بین دو اتم اوربیتالهای اتمی آنها با یکدیگر همپوشانی کرده و اوربیتالهای مولکولی را پدید میآورند. در این اوربیتالها ، الکترونهاهسته قرار دارند و بر حسب قاعده آفبا در این اوربیتالها چیده میشوند. در یک محیط مولکولی تحت تاثیر دو
نگاه اجمالی
اوربیتالهای مولکولی را با توجه به این که از همپوشانی کدام اوربیتال اتمی پدید آمده باشند، باحروف یونانی σ (سیگما) و π (پی) نمایش میدهند. موقع تشکیل یک پیوند دو اوربیتال مولکولی حاصل میشود که با توجه به سطح انرژی نسبت به اوربیتالهای اتمی به اوربیتالهای مولکولی پیوندی و ضد پیوندی شهرت دارند. به همان اندازه که اوربیتال مولکولی پیوندی ، مولکول را پایدار میکند، اوربیتال مولکولی ضد پیوندی باعث ناپایداری پیوندی میشود.
با توجه به نارساییهای نظریه پیوند ظرفیت ، هوندا در سال 1928 و مولیکن در سال 1931 نظریه دیگری بر اساس مدل موج اتم در مورد چگونگی تشکیل پیوند کووالانسی ارائه دادند که نظریه اوربیتال مولکولی نام گرفته است و به کمک آن بسیاری از خواص مغناطیسی ، ترازهای انرژی ، خواص طیفی و ... را به روشنی میتوان توجیه کرد. در این نظریه برعکس نظریه پیوند (که فقط دخالت لایه ظرفیت اتمها را در تشکیل پیوند در نظر میگیرد) بر اساس این نظریه ، تمام اوربیتالهای اتم میتواند در تشکیل اوربیتالهای مولکولی شرکت داشته باشد و این اوربیتالها بین چندین اتم و حتی در سراسر مولکول گسترده یا غیر مستقرند.
برای مولکول نیز مانند اتم ، ترازهای انرژی در نظر گرفته میشود که الکترونهای مولکول آنها را مطابق اصل آفبا ، اصل طرد پائولی و قاعده هوند (همانند ترازهای انرژی در اتمها) اشغال میکنند. علاوه بر اوربیتالهای پیوندی و غیر پیوندی ، اوربیتالهای ضد پیوندی نیز در تشکیل پیوند و توجیه پایداری و یا ناپایداری مولکول در نظر گرفته میشود و به تعداد اوربیتالهای اتمی شرکت کننده ، اوربیتالهای مولکول تشکیل میشود.
شرایط همپوشانی اوربیتالها
برای اینکه اوربیتالهای اتمی بتوانند در حد تشکیل پیوند یکدیگر همپوشانی کنند باید دو شرط زیر درباره آنها برقرار باشد:
شرط انرژی
فقط اوربیتالهایی میتوانند با یکدیگر همپوشانی کنند که دریک سطح انرژی قرار داشته و یا سطوح انرژی آنها به اندازه کافی به یکدیگر نزدیک باشد. مثلا اوربیتال 3p یک اتم کلر میتواند فقط با اوربیتال 3p اتم دیگر کلر همپوشانی کند. اوربیتال S اتم H نمیتواند با اوربیتال 1S یا 2S و … اتم کلر همپوشانی کند، زیرا در سطح انرژی بالاتری نسبت به آنها قرار دارد.
شرط تقارن
فقط اوربیتالهایی میتوانند با یکدیگر همپوشانی کنند که نسبت به محور اصلی مولکول تقارن یکسانی داشته باشند. از اینرو ، مثلا اوربیتال S که تقارن کروی دارد، در تشکیل مولکولهای خطی میتواند با اوربیتال 2P که نسبت به محور اصلی مولکولی (محور Z) تقارن کامل دارد همپوشانی داشته باشد.

انواع اوربیتالهای مولکولی
اوربیتال مولکولی پیوندی
اوربیتال مولکولی که در آن چگالی در ناحیه بین هستهها زیاد است. انرژی دو الکترون که در اوربیتال مولکولی پیوندی قرار میگیرند کمتر از هنگامی است که در اوربیتالهای اتمی بوجود آورنده آن قرار گرفته باشند.
اوربیتال مولکولی ضد پیوندی
اوربیتال مولکولی که در آن چگالی الکترونی در ناحیه بین هستهها کم است. انرژی دو الکترون که در اوربیتال مولکولی ضد پیوندی قرار میگیرند بیشتر از هنگامی است که در اوربیتالهای اتمی بوجود آورنده آن قرار گرفته باشند.
اوربیتال مولکولی غیر پیوندی
هر گاه دو اتم نتوانند به طریقی بهم نزدیک شوند که امکان همپوشانی اوربیتالهای آنها بوجود آید، همپوشانی اوربیتالها صورت نمیگیرد و در نتیجه ، اوربیتالهای اتمی به صورت غیر پیوندی در مولکول باقی خواهند ماند. اوربیتالهای مولکولی را نیز با حروف یونانی δ (سیگما) ، π (پی) و ... نشانه گذاری میکنند.
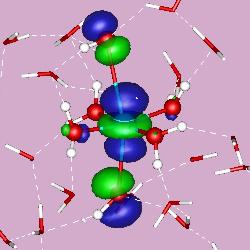
اوربیتالهای مولکولی سیگما: اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتمها در امتداد یکی از محورها مثلا x به صورت خطی در نظر بگیریم، دو اوربیتال اتمی (مثلا 1S) به یکدیگر نزدیک میشوند و در نتیجه همپوشانی ، دو اوربیتال مولکولی پیوندی سیگما و ضد پیوندی سیگما را به وجود میآورند. تمام اوربیتالهای سیگما ، نسبت به محور بین دو هسته کاملا متقارنند و چرخش مولکول به دور این محور ، تغییر قابل مشاهدهای در شکل اوربیتال بوجود نمیآورد.
نمودار تراز انرژی تشکیل اوربیتالهای مولکولی 1S δ و *1S δ از اوربیتالهای اتمی 1S دو اتم به شکل زیر میباشد:
اوربیتال مولکولی پیوندی نشان دهنده کاهش انرژی سیستم و اوربیتال مولکولی ضد پیوندی نشان دهنده افزایش انرژی سیستم است. هر اوربیتال مولکولی میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن ، دو الکترون (با اسپینهای جفت شده) اوربیتال 1S δ را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال δ*1S اشغال نشده است. تعداد پیوند (مرتبه پیوند) ، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
(تعداد الکترونهای ضد پیوندی - تعداد الکترونهای پیوندی) 2/1 = مرتبه پیوند
برای H2 داریم:
1=2/(0-2) = مرتبه پیوند
در مورد ترکیب دو اتم هلیوم ، باید مجموع چهار الکترون در دو اوربیتال مولکولی جای داده شوند. با جای دادن دو الکترون در اوربیتال δ 1S دو الکترون دیگر ناگزیر δ* 1s را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
0=(2-2)2/1=مرتبه پیوند
لذا هلیوم به صورت مولکولی He2 نمیتواند وجود داشته باشد. اثر جدا کننده الکترونهای ضد پیوندی ، اثر اتصال دهنده الکترونهای پیوندی را خنثی میکند. شواهدی در دست است که نشان میدهد یونهای مولکولیو
میتوانند در شرایط ویژهای وجود داشته باشند. ترکیب دو اوربیتال 2S ، اوربیتالهای مولکولی 2S δ و *2S δ را بوجود میآورند که با اوربیتالهای δ و *δ ناشی از ترکیب دو اوربیتال 1S مشابهند.
اما اوربیتالهای مولکولی حاصل از ترکیب اوربیتالهای اتمی 2P کمی پیچیدهترند. سه اوربیتال 2P هر اتم ، در محورهای مختصات دکارتی z ، y ، x قرار دارند. اگر تشکیل یک مولکول دو اتمی از طریق نزدیک شدن سر به سر دو اوربیتال اتمی (Py و Pz یا Px) صورت گیرد، در نتیجه همپوشانی ، دو اوربیتال مولکولی 2P δ و *2P δ را بوجود میآورند.
اوربیتالهای مولکولی پی (π)
اگر در تشکیل یک مولکول دو اتمی ، دو اوربیتال اتمی (مثلا) از پهلو بهم نزدیک شوند، دو اوربیتال مولکولی ، یکی اوربیتال مولکولی پیوندی پی (π) و دیگری اوربیتال مولکولی ضد پیوندی پی ستاره (*π) را بوجود میآورند. اوربیتالهای π نسبت به محور بین دو هسته ، تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال P از پهلو ، به تشکیل اوربیتال π میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند.
در هر حال اثر نهایی اوربیتال π ، بهم نگهداشتن مولکول است. اوربیتال *π ، در ناحیه بین دو هسته ، چگالی الکترونی کمی دارد. اثر نهایی مولکول *π جدا کردن دو اتم از یکدیگر است.
سطح انرژی اوربیتالهای مولکولی
انرژی یک اوربیتال مولکولی به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به میزان و نوع همپوشانیx بیشتر از میزان همپوشانی 2Py یا 2Pz میباشد.
در مولکولهایی که اوربیتالهای مولکولی σ از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p) ، این همپوشانی اضافی پیوند σ s به ازای تضعیف پیوند σ p ، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال σ*s و افزایش انرژی σ* p میشود. بنابراین سطح انرژی σ 2p برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جزو
) پایین تر از سطح انرژی π 2p میباشد. البته تاثیر متقابل s-p به میزان نزدیکتر انرژی اوربیتالهای p , s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل
و
) این تاثیر اضافی مساله بوجود نمیآورد.
اوربیتالهای اتمی که در تشکیل آن صورت میگیرد، بستگی دارد. به این ترتیب ، انرژی هر دو اوربیتال مولکولی σ 2s و σ* 2s پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتالهای اتمی 2p حاصل میشود. انرژی اوربیتالهای σ 2p و σ* 2p پایین تر از انرژی هر یک از دو اوربیتال π 2p میباشد. زیرا میزان همپوشانی اوربیتالهای 2P
منبع :: دانشنامه رشد
دوست عزیز، به سایت علمی نخبگان جوان خوش آمدید
مشاهده این پیام به این معنی است که شما در سایت عضو نیستید، لطفا در صورت تمایل جهت عضویت در سایت علمی نخبگان جوان اینجا کلیک کنید.
توجه داشته باشید، در صورتی که عضو سایت نباشید نمی توانید از تمامی امکانات و خدمات سایت استفاده کنید.




 پاسخ با نقل قول
پاسخ با نقل قول


علاقه مندی ها (Bookmarks)