برای اثبات این قانون ، اول لازم است که با قانون های بویل و شارل آشنا شویم .
قانون بویل
رابطهٔ بین فشار و حجم یک گاز در 1662 میلادی توسط رابرت بویل ( Robert Boyle ) اندازه گیری شد . بویل متوجه شد که افزایش فشار وارد شده بر یک گاز با کاهش حجم آن متناسب است . اگر فشار دو برابر شود ، حجم به نصف کاهش مییابد . اگر فشار سه برابر شود ، حجم به یک سوم حجم اولیه اش میرسد . قانون بویل میگوید که در دمای ثابت ، حجم گاز با فشار رابطهٔ عکس دارد :
قانون شارل
رابطهٔ بین حجم و دمای یک گاز در 1787 میلادی توسط ژاک شارل ( Jacques Charles ) مطالعه شد و نتایج او به طور قابل ملاحظهای توسط شاگردانش ژوزف گیلوساک ( Joseph Gay - Lussac ) گسترش یافت . براساس این قانون حجم تمام گازها ، در فشار ثابت ، با دمای مطلق آن گاز رابطهٔ مستقیم دارد :
قانون گازهای ایده آل
در دما و فشار ثابت حجم یک گاز با تعداد مول های آن نسبت مستقیم دارد . حجم یک مول گاز نصف حجم اشغال شده توسط 2 مول گاز میباشد . بنابراین قانون و قوانین بویل و شارل میتوان گفت که :
با استفاده از یک عدد ثابت میتوان تناسب را به تساوی تبدیل کرد :
که از آن نتیجه میشود :
PV = nRT
دوست عزیز، به سایت علمی نخبگان جوان خوش آمدید
مشاهده این پیام به این معنی است که شما در سایت عضو نیستید، لطفا در صورت تمایل جهت عضویت در سایت علمی نخبگان جوان اینجا کلیک کنید.
توجه داشته باشید، در صورتی که عضو سایت نباشید نمی توانید از تمامی امکانات و خدمات سایت استفاده کنید.





 پاسخ با نقل قول
پاسخ با نقل قول برخورد دارد و در هر برخورد به اندازهٔ ۲mu اندازهٔ حرکت آن تغییر میکند. پس در هر ثانیه هر مولکول گاز به اندازهٔ زیر به دیوارهٔ مکعب نیرو وارد میکند :
برخورد دارد و در هر برخورد به اندازهٔ ۲mu اندازهٔ حرکت آن تغییر میکند. پس در هر ثانیه هر مولکول گاز به اندازهٔ زیر به دیوارهٔ مکعب نیرو وارد میکند : از این رو برای تمام مولکولهای گاز میتوان نوشت :
از این رو برای تمام مولکولهای گاز میتوان نوشت : فشار عبارت است از نیرو بر سطح. پس :
فشار عبارت است از نیرو بر سطح. پس : پس میتوان نوشت :
پس میتوان نوشت : که KE در آن میانگین انرژی جنبشی مولکولی گاز میباشد. و از آنجا که انرزی جنبشی یک گاز (بنابر نظریه جنبشی گازها) با دمای مطلق آن نسبت مستقیم دارد و همچنین
که KE در آن میانگین انرژی جنبشی مولکولی گاز میباشد. و از آنجا که انرزی جنبشی یک گاز (بنابر نظریه جنبشی گازها) با دمای مطلق آن نسبت مستقیم دارد و همچنین  ، پس :
، پس : که با ضرب کردن عدد ثابتی مثل R، میتوان تناسب را به تساوی تبدیل کرد :
که با ضرب کردن عدد ثابتی مثل R، میتوان تناسب را به تساوی تبدیل کرد : ،
، 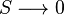

 در صورتی که مادهٔ مورد نظر در دماهای بالا تحت استحالههای فازی قرار گرفته و حالت آن تغییر یابد، باید از صورت کلی فرمول انتروپی به شکل زیر استفاده کرد:
در صورتی که مادهٔ مورد نظر در دماهای بالا تحت استحالههای فازی قرار گرفته و حالت آن تغییر یابد، باید از صورت کلی فرمول انتروپی به شکل زیر استفاده کرد:

 این فرمولها دربرگیرندهٔ دو عامل است که در انجامپذیری واکنشها در طبیعت مؤثرند: آنتالپی (انرژی سیستم) و آنتروپی (بینظمی سیستم).
این فرمولها دربرگیرندهٔ دو عامل است که در انجامپذیری واکنشها در طبیعت مؤثرند: آنتالپی (انرژی سیستم) و آنتروپی (بینظمی سیستم).


علاقه مندی ها (Bookmarks)